Многоцентровая кооперативная проспективно- ретроспективная наблюдательная программа по оценке методов диагностики и лечения лимфомы Ходжкина в Северо-Западном Федеральном округе РФ, 2-ая часть
Главные научные кураторы программы и наблюдательный совет:
«Многоцентровая кооперативная проспективно-ретроспективная наблюдательная программа по оценке эффективности и безопасности лечения лимфомы Ходжкина в Северо-Западном Федеральном округе РФ» инициирована экспертами НИИ детской онкологии, гематологии и трансфузиологии им. Р. М. Горбачевой и ФГБУ «НИИ онкологии им. Н. Н. Петрова» МЗ РФ и будет проводиться под руководством наблюдательного совета.
Главные научные кураторы:
Афанасьев Борис Владимирович
Директор НИИ детской онкологии, гематологии и трансфузиологии им. Р. М. Горбачевой, заведующий кафедрой гематологии, трансфузиологии и трансплантологии ПСПб ГМУ им. академика И. П. Павлова, д.м.н., профессор
Алексеев Сергей Михайлович
Заместитель главного врача по гематологии ФГБУ «НИИ онкологии им. Н. Н. Петрова» Минздрава России, руководитель химиотерапевтическое отделение онкологии, гематологии и трансплантации костного мозга, к.м.н.
Моисеев Иван Сергеевич
Заместитель директора по науке, НИИ детской онкологии, гематологии и трансфузиологии им. Р. М. Горбачевой, заведующий кафедрой гематологии, трансфузиологии и трансплантологии ПСПб ГМУ им. академика И. П. Павлова, к.м.н.
Наблюдательный совет программы:
Афанасьев Борис Владимирович
Директор НИИ детской онкологии, гематологии и трансфузиологии им. Р. М. Горбачевой, заведующий кафедрой гематологии, трансфузиологии и трансплантологии СПб ГМУ им. академика И. П. Павлова, д.м.н., профессор
Беляев Алексей Михайлович
Директор ФГБУ «НИИ онкологии им. Н. Н. Петрова» Минздрава России, главный внештатный онколог Северо-Западного Федерального округа, заведующий кафедрой онкологии Северо-Западного государственного медицинского университета им. И. И. Мечникова, президент Ассоциации онкологов Северо-Запада, д.м.н., профессор
Зарицкий Андрей Юрьевич
Директор института гематологии ФМИЦ им. В. А. Алмазова, профессор кафедры факультетской терапии Санкт-Петербургского государственного медицинского университета им. акад. И. П. Павлова, д.м.н.
Алексеев Сергей Михайлович
Заместитель главного врача по гематологии ФГБУ «НИИ онкологии им. Н. Н. Петрова» Минздрава России, руководитель химиотерапевтическое отделение онкологии, гематологии и трансплантации костного мозга, к.м.н.
Ильин Николай Васильевич
Руководитель радиотерапевтического отделение № 1 Российского Научного Центра Радиологии и Хирургических Технологий, д.м.н., профессор
Михайлова Наталья Борисовна
Руководитель отдела онкологии и химиотерапии Института детской гематологии и трансплантологии им. Р. М. Горбачевой ПСПбГМУ им. ак. И. П. Павлова, к.м.н
Медведева Надежда Вадимовна
Руководитель Санкт-Петербургского городского центра онкогематологии на базе ГКБ № 31 заместитель главного врача по медицинской части врач-гематолог высшей квалификационной категории к.м.н.
Манихас Георгий Моисеевич
Главный врач ГКОД, главный внештатный специалист онколог Санкт-Петербурга, д.м.н., профессор, заслуженный врач РФ
Волошин Сергей Владимирович
Врач высшей категории, к.м.н., ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства», Санкт-Петербург
Моисеенко Владимир Михайлович
Руководитель Санкт-Петербургского клинического научно-практического центра специализированных видов медицинской помощи (онкологический), д.м.н., профессор, заслуженный врач РФ
Шнейдер Татьяна Владимировна
Заведующая онкогематологическим отделением №1 Ленинградской областной клинической больницы, главный внештатный гематолог Ленинградской области
14. МЕТОДОЛОГИЯ СБОРА ДАННЫХ
Поскольку данный проект представляет собой наблюдательную программу, то обязательное оценивание пациентов или центров не требуется. Тем не менее сбор данных/отчетности будет проводиться на постоянной основе во избежание предвзятости в процессе сбора данных и анализа. Собранные данные будут загружаться всеми исследовательскими центрами в электронную систему с использованием утвержденной электронной индивидуальной регистрационной карты пациента (eCRF) и верифицироваться. Данные, необходимые с точки зрения основных целей исследования, а также демографические данные и клинические характеристики пациентов будут браться из eCRF, заполненных персоналом центров.
E-CRF разработана на платформе Quinta (Свидетельство о государственной регистрации программы ЭВМ № 2016615129 «Универсальный программный комплекс для сбора, обработки и управления территориально распределенными клинико-эпидемиологическими данными в режиме удаленного доступа «Quinta»», правообладатель ЗАО «Астон Консалтинг»). Ее использование происходит через индивидуальный электронный удаленный on-line доступ: индивидуальный логин и пароль. Рекомендованный браузер для работы Microsoft Internet Explorer 10.0 (интернет настройка).
Для фиксации данных наблюдении пациентов в электронной карте предусмотрена следующая схема из 18 визитов в течении 4 лет с кратностью внесения информации раз в три месяца: Визит 0 – регистрационный визит, Визит 0’/ 15 – мониторинговые визиты, Визит 16 – закрывающий мониторинговый визит. Регистрационный визит происходит при обращении пациента в любой из включенных в программу центров, и состоит из сбора минимального набора информации: дата обращении пациента в любой из включенных в программу центров, и состоит из сбора минимального набора информации: дата обращения, социально демографические данные, данные лабораторных анализов (в том числе патоморфорфологический диагноз), диагноз, назначенное лечение. при включении в программу пациентов, ранее лечившихся по поводу ЛХ, в регистрационную карту будут вноситься ретроспективные данные обследования и лечения и проспективные результаты. Каждый последующий мониторинговый визит собирает всю необходимую медицинскую информацию за прошедшие три месяца, в том числе статус пациента (жив или мертв, в ремиссии или с рецидивом и т.д.), что позволит оценить в последующем общую выживаемость, выживаемость без прогрессирования и другие вторичные точки исследования.
15. РАЗМЕР ВЫБОРКИ
Поскольку программа является наблюдательной и не предлагает доказательства никакой гипотезы, то расчет выборки не производился. Однако в программу планируется достаточное для поставленных задач число пациентов – 900 человек.
16. ПЛАН СТАТИСТИЧЕСКОГО АНАЛИЗА
Исследование носит описательный характер. Все собранные данные и переменные конечных точек будут суммированы с использованием методов описательной статистики и статистического моделирования. Сводные таблицы будут представлены по группам лечения с включением количества случаев (N), средних значений (М), стандартных отклонений (SD), медиан (Me), минимальных (min) и максимальных (max) значений для непрерывных переменных, а также количества и процентной доли в соответствии с категорией для категориальных данных. Будут представлены кривые выживаемости, полученные по методу Каплана-Майера, и 25-й, 50-й (медиана) и 75-й процентили наряду с анализом значимости при 2-стороннем уровне для 95% ДИ для данных времени до наступления события.
Статистические методы
Сравнение непараметрических величин между группами будет проводиться тестом Манна-Уитни. Сравнение числовых переменных между группами будет проводится двусторонним t-тестом. Сравнение показателей выживаемости без прогрессирования (ИБП) и общей выживаемости (ОВ) между группами лечения будет проводится с использованием log-ранг теста. Многофакторный анализ ВБП и ОВ будет проводиться на основании построения моделей пропорционального риска. Для пациентов, которым проводится аутологичная и аллогенная ТСК трансплантационная летальность и рецидивы будут расцениваться как конкурирующие риски. Статистическая значимость для всех тестов устанавливается на уровне 0.05.
Расчет фармакоэкономики на одного пациента будет проводиться исходя из следующих параметров: стоимость химиопрепаратов и сопроводительных препаратов, стоимость дополнительных исследований, стоимость логистических и дополнительных расходов, стоимость лечения осложнений в соответствии со стандартами МЗ РФ, расходы на оплату нетрудоспособности, исходя из параметров средней заработной платы по региону и длительности лечения по протоколу.
Статистическая обработка полученных результатов:
В целом, сводные таблицы будут представлены по группам лечения с включением количества случаев, средних значений, стандартных отклонений, медиан, минимальных и максимальных значений для непрерывных переменных, а также количества и процентной доли в соответствии с категорией для категориальных данных. Будут представлены кривые выживаемости, полученные по методу Каплана-Майера, и 25-й, 50-й (медиана) и 75-й процентили наряду с анализом значимости при 2-стороннем уровне для 95% ДИ для данных времени до наступления события.
Определение конечных точек исследования:
Выживаемость без прогрессирования: время от начала лечения в рамках 1-ой, 2-ой или 3-ей линии химиотерапии до смерти, рецидива или прогрессии ЛХ.
Общая выживаемость: время от начала лечения в рамках 1-ой, 2-ой или 3-ей линии химиотерапии до смерти.
Полная ремиссия: ПЭТ- негативный статус (Deauville ≤3) даже при сохраняющихся резидуальных массах20.
Частичный ответ: Регресс ≥50% шести наиболее крупных опухолевых масс при отсутствии появления новых опухолевых очагов и одного или более ПЭТ- позитивного опухолевого очага20.
Прогрессия/рецидив: появление новых опухолевых очагов более 1.5 см, или увеличение на 50% суммы диаметров по крайней мере одного из опухолевых очагов, или увеличение на 50% в одном измерении ранее существовавшего очага> 1 см, или появление новых ПЭТ- позитивных опухолевых очагов (Deauville >3)20.
Пациенты будут исследоваться в течение как минимум четырех лет с момента начала терапии и будут постоянно наблюдаться в течении и после лечения один раз в три месяца до момента, когда ими будет отозвано согласие на участие или до момента смерти, или исчезновения из поля зрения исследователей.
Рандомизация
В группе пациентов, которые с самого начала лечения курировались с использованием ПЭТ будет проводится рандомизация. Рандомизация будет проводиться на момент достижения полной ПЭТ-негативной ремиссии после двух курсов терапии в группе высокого риска. В ходе рандомизации будет выполняться стратификация риска по IPS на основании U-критерия теста Манна-Уитни.
С учетом рандомизации 60% всех пациентов, включенных в программу, отношение риска худшего результата (inferiority) на 1, 2 и 3 года рассчитывается из числа 180, 360 и 540 пациентов, с ожидаемой частотой наступления события 15%, выбранной на основании литературных данных13. Сила анализа – 80%. Исходя из количества пациентов и силы исследования за худший результат (inferiority) принимается отношение рисков (HR) БРВ 11.0, 3.5 и 2.2 для промежуточного анализа на 1, 2 и 3 года исследования, соответственно. Результаты промежуточного анализа предоставляются наблюдательному совету для решения вопроса о целесообразности продолжения рандомизации. При оценке окончательных показателей 5-летней БРВ худший результат (inferiority) – HR> 1.1.
17. ЭТИЧЕСКИЕ АСПЕКТЫ
Данная программа была разработана и будет проводиться в соответствии с этическими принципами Хельсинской декларации, трехсторонним соглашением Международной Конференции по Гармонизации и российским ГОСТом по надлежащей клинической практике.
Пациенты, подходящие по критериям, могут быть включены в программу только после подписания формы информированного согласия, одобренной Независимым или Локальным Этическим Комитетом. Подписанное информированное согласие необходимо получить до применения процессов, описанных в настоящем протоколе. Процесс получения подписанного информированного согласия должен быть отражен в первичной исследовательской документации по каждому пациенту.
Персональные данные пациентов будут использоваться исключительно в целях наблюдательной программы. Любая информация, с помощью которой можно идентифицировать пациентов, не подлежит раскрытию. Идентификация пациентов в базе данных будет осуществляться на сновании присвоенных номеров.
В силу наблюдательного и неинтервенционного характера данного исследования протокол исследования, карта пациента, форма информированного согласия и информация, предоставляемая пациентам, не должны получать одобрения российского Министерства здравоохранения и социального развития, Совета по этике при Министерстве Здравоохранения и этических комитетов в местах проведения исследования.
18. КОНФИДЕНЦИАЛЬНОСТЬ ПЕРСОНАЛЬНЫХ ДАННЫХ
Конфиденциальность ПД находится под защитой действующего законодательства. ЗАО «Астон Консалтинг» является официально зарегистрированным оператором персональных данных (ссылка на документ), что дает возможность врачу-участнику программы при подписании информированного согласия не кодировать пациентов, вносить их персональные данные (а именно ФИО, дату рождения, возраст) в базу данных для обработки (информированное согласие – приложение 4). После введения ФИО пациента e-CRF генерирует код, под которым пациент будет виден другим участникам программы, не имеющим доступ к полной базе данных.
Персональные данные пациентов, принимающих участие в программе, будут сохраняться в тайне. Идентификация пациентов будет осуществляться при помощи уникальных номеров, присвоенных пациентам e-CRF.
19. МОНИТОРИНГ
Мониторинг во всех центрах, включающих пациентов в программу будет проводиться 2 раза в год. В случае выявления несоответствия первичной медицинской документации и eCRF, которые не повлияли на выбор схем лечения, eCRF приводится в соответствие с первичной документацией.
20. ОЖИДАЕМЫЕ РЕЗУЛЬТАТЫ
Ожидается улучшения качества оказания медицинской помощи пациентам с ЛХ в Северо-Западном Федеральном округе Российской Федерации, повышение безрецидивной выживаемости, снижение токсичности проводимой терапии и уменьшение долгосрочных эффектов лечения. Также ожидается снижение финансовой нагрузки на территориальные фонды социального страхования за счет уменьшения числа резистентных пациентов, требующих непрерывного длительного лечения и социальной поддержки. Ожидаемые научные результаты исследования: подтверждение возможности исключения этапа лучевой терапии у пациентов низкого риска с ПЭТ(-) статусом, отсутствие компрометации эффективности лечения при деэскалационной тактике при распространенных стадиях, возможность исключения блеомицина и снижения пульмотоксичности на этапах деэскалации терапии.
21. БЛОКИ ДАННЫХ, ОБЯЗАТЕЛЬНЫЕ ДЛЯ РЕГИСТРАЦИИ В E-CRF:
Схематичная форма регистрируемых параметров представлена в приложении 5.
Первичная регистрация в электронной системе:
1. Фамилия/Имя/Отчество
2. Пол
3. Дата рождения _____ Возраст (калькулятор)
4. Регион
5. Телефон для связи
6. Социальный статус (работающий, неработающий, учащийся, пенсионер)
7. Дата внесения регистрационной информации
Первичное стадирование:
1. Дата постановки диагноза
2. Длительность заболевания на момент включения па циента в программу
3. Гистологический вариант заболевания
4. Дата биопсии, по которой был поставлен гистологи-
ческий диагноз
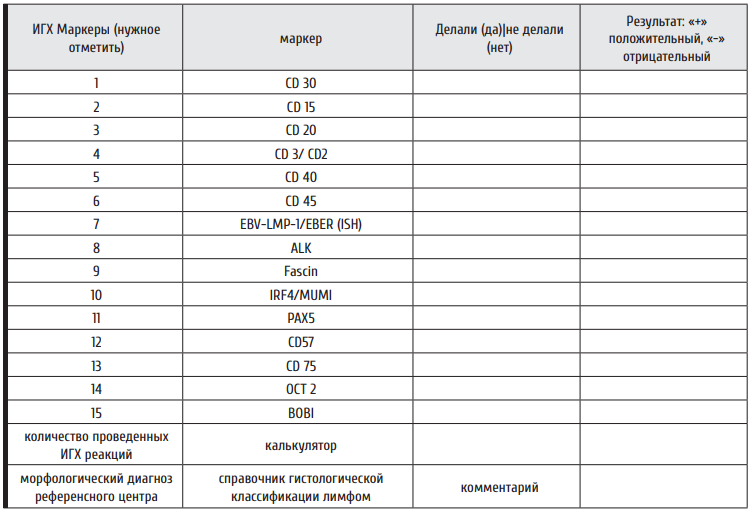
5. Проводилось ли ИГХ диагностика:
6. Если проводилась ИГХ диагностика, необходимо отметить ИГХ Маркеры (нужное отметить)
7. Стадия по классификации Ann Arbor
8. Вовлеченные зоны по данным ПЭТ-КТ
9. Максимальные размеры опухоли для 6 очагов (либо
меньше, если вовлечены менее 6)
10. Уровень метаболической активности по Deauville для 6 очагов (либо меньше, если вовлечены менее 6)
11. ВИЧ-статус (в случае положительного – вирусная нагрузка, CD4+ в мкл).
12. СОЭ
13. ЛДГ
14. АЛТ
15. АСТ
16. Креатинин
17. Билирубин
18. Гемоглобин
19. Альбумин
20. Абсолютное число лейкоцитов
21. Абсолютное число нейтрофилов
22. Абсолютное число лимфоцитов
23. Тромбоциты
24. Вариант терапии первой линии
25. Запланированное число курсов (не для RNWOHGHD1)
26. Дата начала 1-ого цикла химиотерапии
27. Препараты 1ого цикла химиотерапии: длительность
и дозы
Рестадирование после двух циклов химиотерапии:
1. Дата начала 2-ого цикла химиотерапии
2. Препараты 2-ого цикла химиотерапии: длительность и дозы
3. Ответ по оценке лечащего врача
4. Максимальный уровень метаболической активности по Deauville
5. Вовлеченные зоны по данным ПЭТ-КТ
6. Максимальные размеры опухоли для 6 очагов (либо меньше, если вовлечены менее 6)
7. Уровень метаболической активности по Deauville для 6 очагов (либо меньше, если вовлечены менее 6)
8. Токсичность, если была, по NCI CTCAE 4.03
9. Инфекционные осложнения, если были
10. Потребность в Г-КСФ
11. Количество переливаний эритроцитов
12. Другая сопроводительная терапия
Рестадирование после четырех циклов химиотерапии (где применимо):
1. Дата начала курсов химиотерапии
2. Препараты химиотерапии
3. Ответ по оценке лечащего врача
4. Максимальный уровень метаболической активности по Deauville
5. Вовлеченные зоны по данным КТ
6. Максимальные размеры опухоли для 6 очагов (либо меньше, если вовлечены менее 6)
7. Токсичность, если была, по NCI CTCAE 4.03
8. Инфекционные осложнения, если были
9. Потребность в Г-КСФ
10. Количество переливаний эритроцитов
11. Другая сопроводительная терапия
12. Рестадирование после шести циклов химиотерапии (где применимо):
13. Дата начала курсов химиотерапии
14. Ответ по оценке лечащего врача
15. Максимальный уровень метаболической активности по Deauville
16. Вовлеченные зоны по данным ПЭТ-КТ
17. Максимальные размеры опухоли для 6 очагов (либо меньше, если вовлечены менее 3)
18. Уровень метаболической активности по Deauville для 6 очагов (либо меньше, если вовлечены менее 6)
19. Токсичность, если была, по NCI CTCAE 4.03
20. Инфекционные осложнения, если были
21. Потребность в Г-КСФ
22. Количество переливаний эритроцитов
23. Другая сопроводительная терапия
Рестадирование после лучевой терапии (где применимо):
1. Дата начала лучевой терапии
2. Режим лучевой терапии
3. Доза лучевой терапии
4. Ответ по оценке лечащего врача
5. Максимальный уровень метаболической активности по Deauville
6. Вовлеченные зоны по данным КТ
7. Максимальные размеры опухоли для 6 очагов (либо
меньше, если вовлечены менее 6)
8. Токсичность, если была, по NCI CTCAE 4.03
Наблюдение каждые 6 месяцев после окончания лечения:
1. Дата контакта
2. Жив/умер/потеряна связь
3. Статус заболевания
4. Остаточные побочные явления, если есть, по NCI CTCAE 4.03
5. Для женщин факт наличия беременности (планировалась – не было, не планировалась – не было, была – аборт, в анамнезе – невынашивание, в анмнезе – роды)
Статус на момент рецидива/прогрессии после 1-ой линии (где применимо):
1. Дата фиксации рецидива
2. Длительность от момента первичной диагностики заболевания
3. Стадия по классификации Ann Arbor
4. Вовлеченные зоны по данным ПЭТ-КТ
5. Максимальные размеры опухоли для 6 очагов (либо меньше, если вовлечены менее 3)
6. Уровень метаболической активности по Deauville для 6 очагов (либо меньше, если вовлечены менее 6)
7. СОЭ
8. ЛДГ
9. АЛТ
10. АСТ
11. Креатинин
12. Билирубин
13. Гемоглобин
14. Альбумин
15. Абсолютное число лейкоцитов
16. Абсолютное число нейтрофилов
17. Абсолютное число лимфоцитов
18. Тромбоциты
19. Дата начала химиотерапии второй линии
20. Вариант химиотерапии второй линии: DHAP, IGEV, ICE, брентуксимаб, брентуксимаб + бендамустин, BEACOPP, DexaBeam, LABO, другая (вписать)
Статус после 2-ой линии химиотерапии (где применимо):
1. Дата рестадирования
2. Ответ по оценке лечащего врача
3. Максимальный уровень метаболической активности по Deauville
4. Вовлеченные зоны по данным ПЭТ-КТ
5. Максимальные размеры опухоли для 6 зон (либо меньше, если вовлечены менее 6)
6. Уровень метаболической активности по Deauville для 6 зон (либо меньше, если вовлечены менее 3)
7. Токсичность, если была, по NCI CTCAE 4.03
8. Инфекционные осложнения, если были
9. Потребность в Г-КСФ
10. Количество переливаний эритроцитов
11. Другая сопроводительная терапия
12. Направлен на аутоТКМ: да/нет
13. Причина, если не направлен на аутоТКМ: не кандидат (и причина), неудача сбора стволовых клеток, отзыв согласия
Статус после аутоТКМ (где применимо):
1. Дата ТКМ
2. Дата рестадирования
3. Режим кондиционирования
4. Количество CD34+ в трансплантате
5. Ответ по оценке лечащего врача
6. Максимальный уровень метаболической активности по Deauville
7. Вовлеченные зоны по данным ПЭТ-КТ
8. Максимальные размеры опухоли для 6 зон (либо меньше, если вовлечены менее 6)
9. Уровень метаболической активности по Deauville для 6 зон (либо меньше, если вовлечены менее 6)
10. Токсичность, если была, по NCI CTCAE 4.03
11. Инфекционные осложнения, если были
12. Поддерживающая терапия брентуксимабом – да/нет
Статус на момент рецидива/прогрессии после 2-ой линии (где применимо):
1. Стадия по классификации Ann Arbor
2. Вовлеченные зоны по данным ПЭТ-КТ
3. Максимальные размеры опухоли для 6 зон (либо меньше, если вовлечены менее 6)
4. Уровень метаболической активности по Deauville для 6 зон (либо меньше, если вовлечены менее 6)
5. СОЭ
6. ЛДГ
7. Гемоглобин
8. Альбумин
9. Абсолютное число лейкоцитов
10. Абсолютное число нейтрофилов
11. Абсолютное число лимфоцитов
12. Тромбоциты
13. Дата начала терапии третьей линии
14. Вариант терапии третьей линии: брентуксимаб или другой
15. Направлен на аллоТКМ да/нет
16. Причины невыполнения аллоТКМ: нет донора/отзыв согласия/другая
6. ЛДГ
7. Гемоглобин
8. Альбумин
9. Абсолютное число лейкоцитов
10. Абсолютное число нейтрофилов
11. Абсолютное число лимфоцитов
12. Тромбоциты
13. Дата начала терапии третьей линии
14. Вариант терапии третьей линии: брентуксимаб или другой
15. Направлен на аллоТКМ да/нет
16. Причины невыполнения аллоТКМ: нет донора/отзыв согласия/другая
Пациенты ретроспективной ветки наблюдательной программы RHWOHG-HD1, могут быть отнесены к группе интенсивного или неинтенсивного ведения.
Неблагоприятные факторы, требующие включения пациента к интенсивной ветке протокола лечения:
– массивная (bulky) медиастинальная опухоль >10 см
– экстранодальное поражение, в том числе по контакту
– скорость оседания эритроцитов (СОЭ) >50 мм/ч
– вовлечение трех и более групп лимфоузлов.
Первая линия
Неинтенсивная ветка протокола (стадия I-IIA и нет неблагоприятных факторов):
• Проводится 2 курса ABVD.
• Выполняется ПЭТ-КТ.
• При достижении ПЭТ(-) ПР проводится наблюдение.
• При достижении ПЭТ(+) ЧО проводится радиотерапия 20 Gy и последующее наблюдение.
• При ПЭТ(+) статусе менее ЧО проводится 4 курса BEACOPP-14 или BEACOPPesc (на усмотрение лечебного учреждения) с промежуточной КТ после 2-х курсов. При наличии прогрессии по данным промежуточной КТ, пациент переводится на вторую линию терапии, во все остальных случаях продолжается терапия BEACOPP-14 или BEACOPPesc.
• При ПЭТ(-) ПР после 4 курсов BEACOPP-14 или BEACOPPesc проводится наблюдение.
• При ПЭТ(+) статусе, размере лимфоузлов менее 2.5 см и SUV<6 после 4 курсов BEACOPP-14 или BEACOPPesc проводится радиотерапия 30 Gy, при размере лимфоузлов более 2.5 см или SUV>6 пациент переводится на вторую линию терапии.
Интенсивная ветка протокола (стадия IIB-IV или есть неблагоприятные факторы):
• Проводится 2 курса BEACOPP-14 или BEACOPPesc (на усмотрение лечебного учреждения).
• Выполняется ПЭТ-КТ.
• При достижении ПЭТ(-) ПР проводится рандомизация со стратификацией риска по международной прогностической системе (IPS) между 4 курсами ABVD и AVD. После 2-х курсов выполняется промежуточная КТ. При сохранении ремиссии проводится еще два курса, при наличии рецидива пациент переводится на 2-ую линию. После завершения терапии проводится ПЭТ-КТ, при сохранении ремиссии проводится наблюдение.
• При наличии ПЭТ(+) статуса, но без критериев прогрессии, проводится 4 курса BEACOPP-14 или BEACOPPesc (на усмотрение лечебного учреждения) с промежуточной КТ после 2-х курсов. При наличии прогрессии по данным промежуточной КТ, пациент переводится на вторую линию терапии, во все остальных случаях продолжается терапия BEACOPP-14 или BEACOPPesc.
• При ПЭТ(+) статусе, размере лимфоузлов менее 2.5 см и SUV<6 после 6 курсов BEACOPP-14 или BEACOPPesc проводится радиотерапия 30 Gy, при размере лимфоузлов более 2.5 см или SUV>6 пациент переводится на вторую линию терапии.
• При наличии прогрессии на любом этапе, пациент переводится на вторую линию терапии.


